氯化铝是强酸弱碱盐,其溶液呈酸性,升高温度促进铝离子水解,蒸干时生成氢氧化铝,灼烧时氢氧化铝分化.
回答解:氯化铝为强酸弱碱盐,Al3+产生水解,水解的方程式为Al3++3H2O?Al(OH)3+3H+,水解后溶液呈酸性,加热时促进水解,加热进程中,氯化氢蒸发促进了铝离子的水解,蒸干溶液得到Al(OH)3,Al(OH)3不稳定,灼烧时分化生成Al2O3,所以白色物质是氧化铝,故答案为Al2O3.
点评本题考察了盐类的水解,留意蒸干、灼烧氯化铝溶液和硫酸铝溶液得到固体成分是否相同,不同的原因是什么是易错点.
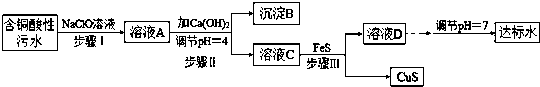
(3)进程II中,调理溶液的pH=4的意图为使沉积彻底,避免沉积,避免FeS溶解.
(4)有的人觉得,进程II中只需参加Ca(OH)2调理溶液的pH=7,即可将污水处理成符合规定规范的合格水,该观念不合理(填“合理”或“不合理”),试经过简略核算阐明理由pH=7时溶液中c(Cu2+)=2.2×10-20÷(10-7)2=2.2×10-6molL-1,大于国家规定的排放规范c(Cu2+)≤1.0×10-7molL-1.
(5)进程III中所产生的首要反响的离子方程式为Cu2++FeS=CuS+Fe2+;该进程不选用易溶的Na2S作沉积剂,其原因可能为Na2S价格高且引进过多杂质离子.
(6)上述整个处理工艺中,能收回的金属化合物有Fe(OH)3、CuS(填化学式).
(2)混合气体缓慢经过1000mL0.12molL-1的氢氧化钡溶液,产生沉积的质量为多少?
(1)C的价层电子排布式为2s22p3,CA3分子的空间构型为三角锥形;
结构类似,计算由A、B、C构成的原子个数比为1:1:1的化合物中σ键与π键数目之比为1:1,该化合物中B原子轨道的杂化类型是sp,BC
(3)A、B构成的某共价化合物与CA3分子电子数持平,后者在水中的溶解度远大于前者,原因是NH3能够与水分子构成氢键;
(4)D与E所构成化合物晶体的晶胞如图所示,晶胞棱长为anm.(已知该化合物摩尔质量为Mg/mol)
(4)0.2mol化合物Z2W2与水反响搬运电子的物质的量为0.3mol,生成一种能使品红溶液褪色的气体,该反响进程中只要一种元素化合价产生显着的改变,该反响的化学方程式为2S2Cl2+2H2O═3S↓+SO2↑+4HCl.



最终所得白色固体的首要成分是Al 发表时间:2024-03-08
来源:行业新闻





 闽公安备案 闽ICP备16038609号 备案号
闽公安备案 闽ICP备16038609号 备案号